CAPÍTULO VI - CÁLCULOS QUÍMICOS
LEIS PONDERAIS
Lei de Lavoisier (Lei da Conservação das Massas)
Numa reação química, a massa total do reagente é numericamente igual à massa total do produto
Hidrogênio + Oxigênio ====> Água
2g 16g 18g
Lei de Proust ( Lei das Proporções Constantes)
Numa reação química, a proporção entre as massas das substâncias participantes é sempre constante.
Hidrogênio + Oxigênio ====> Água
2g 16g 18g
Hidrogênio + Oxigênio ====> Água
4g 32g 36g
Unidade de Massa Atômica ( μ )
Atualmente nossa escala de massa atômica está baseada no isótopo mais comum do Carcono, com número de massa igual a 12 (12C), ao qual foi atribuída exatamente a massa de 12 unidades de massa atômica ( μ ).
Unidade de massa atômica ( μ ): é a massa de 1/12 do átomo do Carbono com número de massa igual a 12 (12C).
Massa molecular ( MM )
É a soma das massas atômicas dos átomos que constituem as moléculas.
Vejamos alguns exemplos:( massas atômicas: H=1u, O=16u, C=12u ).
H2O ===> 2 . 1 = 2 + 1 . 16 = 16 MM = 18u
C5H10 ==> 5 . 12 = 60 + 10 . 1 = 10 MM = 70u
MOL
“É a quantidade de matéria de um sistema que contém tantas entidades elementares quantos são os átomos contidos em 0,012 kg de 12C”.
No nosso cotidiano, compramos, vendemos e contamos coisas indicando sua massa (1kg de açúcar) ou seu volume (1 L de leite) ou ainda seu número de unidades.
Em química, as quantidades de átomos, moléculas e partículas, são indicadas utilizando-se o termo mol.
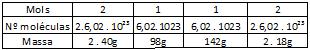
O valor dessa quantidade de partículas é igual a 6,02 . 1023 (602 sextilhões), conhecido como Número de Avogadro.
1 mol = 602 . 000 . 000 . 000 . 000 . 000 . 000 . 000 = 6,02.1023 partículas.
MOL É A QUANTIDADE DE MATÉRIA QUE CONTÉM => 6,02.1023 PARTÍCULAS
Assim, 1 mol de :
Átomos de Hidrogênio = 6,02.1023 átomos de Hidrogênio.
Moléculas de H2O = 6,02.1023 moléculas de H2O.
Massa molar (M)
É a massa, em gramas de um mol de partículas (átomos, moléculas, íons).
A massa atômica (MA) e a massa molar (M) do elemento, são numericamente iguais. O mesmo acontece com a massa molecular (MM) e a massa molar (M) da molécula.
Exemplos:
I – Qual a massa molar de Al ? ( MA = 27u)
1 mol de Al = 6,02.1023 átomos
Massa molar de Al = 27g/mol.
II – Qual a massa molar de H2SO4? ( MM = 98u)
1 mol de H2SO4 = 6,02.1023 moléculas
Massa molar de H2SO4 = 98g/mol.
Número de mols (n)
Para calcularmos o número de mols que há em uma determinada amostra, basta dividirmos a massa da amostra pela massa molar da substância.
Exemplos:
1) Calcular quantos mols de H2O, existem em 270g de amostra. Dados: H=1g/mol; O=16g/mol.
MH2O = 2.1 + 1.16 = 18g/mol.
Logo, em 270 g de água (H2O), existem 15 mols.
2) Determine quantas moléculas existem na amostra de 270g de H2O.
1 mol = 18g = 6,02.1023 moléculas, logo:
Volume Molar (V)
É o volume ocupado por 1 mol de qualquer gás, nas CNTP (Condições Normais de Temperatura e Pressão), ocupa um volume de 22,4 Litros (L), temos temperatura 0°C e pressão atmosférica de 1 atm (uma atmosfera).
Exemplo:
Calcule quantos litros de gás carbônico existem em 8 mols do mesmo.
CÁLCULO ESTEQUIMÉTRICO
O cálculo estequiométrico trata da determinação de quantidade, isto é, massa, quantidade de mols, volume, etc..
Passos para efetuar os cálculos:
· Escrever a equação química
· Balancear a equação
· Relacionar os dados do problema com a incógnita
Os coeficientes das substâncias nas equações químicas são interpretados como sendo mols. Assim, pode-se relacionar cada substância que participa da reação com seu número de moléculas, mols, massa, ou com seu volume (caso a substância seja um gás).
Exemplos:
a) 2 C(s) + O2 (g) =======è 2 CO2 (g)
a) 2 NaOH + H2SO4 ==========è Na2SO4 + 2 H2O
EXECÍCIOS RESOLVIDOS
1) Na produção de monóxido de carbono a partir da reação do Carbono com o gás Oxigênio, qual o volume de óxido obtido nas CNTP se forem consumidos 90g de Carbono?
2 C + O2 ========> 2 CO
Equação: 2 . 12g 2 . 22,4 L
90g x
x = 179,2 litros
24 . x = 90 . 44,8 24 . x = 4032
x = 4032 / 24 x = 168 L
Resposta: x = 168 L de CO
2) Quantos mols de ácido sulfúrico são necessários para reagirem completamente com 280g de hidróxido de sódio?
2 NaOH + H2SO4 ========> H2SO4 + 2 H2O
Equação: 2 . 40g 1 mol
280g x
80 . x = 280 . 1 80 . x = 280
x = 280 / 80 x = 3,5 mols
Resposta: x = 3,5 mols de H2SO4
Reagente em excesso
Numa reação química, nem sempre a quantidade de reagentes está presente em proporção estequiométrica, ou seja, na proporção exata para reagir totalmente. Isso pode ser verificado por meio de cálculos estequiométricos.
Exemplo:
3g de carbono são queimados na presença de 80g de Oxigênio. Determine a massa de CO2 formada e a quantidade de reagente em excesso.
C + O2 ==>CO2
Vamos verificar qual é a quantidade de O2 que reage com 3g de Carbono:
Pela proporção em massa temos:
Ou seja, 3g de C reagem com 8g de O2.
Como temos 80g de O2, há excesso desse reagente:
8og – 8g = 72g (excesso de O2).
Sobrarão, portanto 72g de O2 sem reagir.
Vamos calcular a massa de CO2 produzida:
Resposta: Serão produzidos 11g de CO2.
Reagente impuro
Muitas vezes, o reagente vem acompanhado por outras substâncias (impurezas) que não participam da reação.
A quantidade de substância pura que pode ser obtida a cada 100g de amostra (substância bruta) indica a porcentagem de pureza ou o grau de pureza dessa substância.
Exemplo:
São queimados 10g de carvão mineral com 90% de pureza.Determine a massa de Oxigênio (O2) necessária para essa queima.
Para haver uma queima completa, são necessários 32g de Oxigênio (O2) para cada 12 g de carvão (C), como o carvão apresenta 90% de pureza, em 10g tem-se 9g para queimar.
Resposta: Serão necessários 24g de O2
EXERCÍCIOS PROPOSTOS
1) A síntese (formação) da água que pode ser feita quando colocamos a reagir, em condições adequadas, os elementos Hidrogênio e Oxigênio têm a representação:
2 H2 (g) + O2 (g) ==> 2 H2O (vapor)
Nas mesmas condições operacionais de temperatura e pressão, se utilizarmos 200 L de gás Hidrogênio (H2), o volume de gás Oxigênio (O2) necessário será:
a) 150 L
b) 200 L
c) 100 L
d) 300 L
2) “Volume molar” corresponde ao volume ocupado por:
a) Um mol de um gás qualquer, em qualquer temperatura e pressão e tem o valor de 22,4 L.
b) Um mol de um gás qualquer, a 25°C/1 atm, e tem o valor de 22,4 L.
c) Um mol de um gás qualquer, a 0°C/1 atm, e tem o valor de 22,4 L.
d) Uma massa qualquer, de um gás qualquer, a 0°C/1 atm, e tem o valor de 22,4 L.
3) A combustão total (queima total) de 240g de carvão é representada por:
C (s) + O2 (g) ====> CO2 (g)
Sabendo-se que C = 12 g / mol e O = 16 g / mol, podemos afirmar que, nas CNTP, o volume de CO2 formado é de:
a) 44,8 L
b) 448 L
c) 22,4 L
d) 224 L
4) Os volumes ocupados por 20g de gás Hidrogênio (H2 = 2 g/mol) e por 64g de gás Oxigênio
(O2 = 32 g/mol) nas CNTP são, respectivamente:
a) 224 L e 44,8 L
b) 22,4 L e 44,8 L
c) 224 L e 4,48 L
d) 22,4 L e 22,4 L
5) Uma aliança de ouro puro tem massa igual a 1,97g. Sabendo-se que Au = 197 g/mol e que o número de Avogadro vale 6,02 x 1023, o número de átomos de ouro que realmente existe nessa aliança é:
a) 6,02 x 1021
b) 6,02 x 1023
c) 6,02 x 1025
d) 0,01
6) Num certo procedimento laboratorial, foram adequadamente aquecidos 24,5g de Clorato de Potássio (KClO3), que se decompõem segundo a equação química:
2 KClO3 ====> 2 KCl + 3 O2
As massas atmosféricas dos elementos químicos envolvidos são: K = 39 g/mol; Cl = 35,5 g/mol;
O = 16 g/mol. Com essas informações, a massa máxima de gás Oxigênio que pode ser obtida é:
a) 96g
b) 48g
c) 9,6g
d) 4,8g
7) A mistura de duas soluções contendo, respectivamente, 248g de Ácido Carbônico (H2CO3) e 156g de Hidróxido de Alumínio, provocará uma reação que produzirá um sal cuja massa será igual a:
(Dados: H=1; C=12; O=16; Al=27)
a) 234g
b) 117g
c) 312g
d) 404g
e) 512g
8) Certa massa de Nitrato de Cobre (Cu(NO3)2) foi calcinada em ambiente aberto até restar um resíduo com massa constante, que é sólido e preto. Formaram-se dois produtos gasosos, conforme a equação química:
2 Cu(NO3)2) (s) ====> 2 CuO (s) + 4 NO2 (g) + O2 (g)
A massa de NO2 formada na reação de decomposição é igual a 18,4g. Qual é o valor que mais se aproxima da massa inicial do Nitrato de Cobre?
(Dados: N = 14; O = 16; Cu = 63,5)
a) 9,4g
b) 37,5g
c) 57,5g
d) 123g
e) 246g
9) A 24g de Magnésio são adicionados 20g de Oxigênio, produzindo Óxido de Magnésio e 4g de Oxigênio em excesso (todo o magnésio foi consumido). As massa de Magnésio e de Oxigênio, em gramas, que devem reagir entre si, para obterem-se 120g de Óxido de Magnésio, são respectivamente:
a) 84 e 36
b) 70 e 50
c) 75 e 45
d) 72 e 48
10) Ao aquecer 100g de Mercúrio na presença do ar, dentro de um recipiente fechado de vidro, obtém-se 54g de Óxido vermelho de Mercúrio, e ficam ainda sem reagir 5og de Mercúrio. A massa necessária para reagir com todo o Mercúrio inicial é:
a) 3g
b) 4g
c) 6g
d) 8g
11) 4g de Cálcio adicionados a 22g de Bromo fornecem 20g de Brometo de Cálcio ao lado de 6g de Bromo em excesso. Numa segunda experiência, 1,6g de Cálcio são adicionados a 4,8g de Bromo.
A Alternativa que indica corretamente a natureza e a quantidade de reagente em excesso, se houver, na segunda experiência, é:
a) 0,4g de Cálcio
b) O,4g de Bromo
c) 0,8g de Bromo
d) Não houve excesso de reagentes
12) Foi descoberta recentemente, em uma fruta brasileira, a sua riqueza em vitamina C. Ela chega a possuir 37g de vitamina C por quilograma da fruta. Sabe-se que a dose diária recomendada dessa vitamina (C6H8O6) é de 62mg.
Se comermos diariamente cerca de 200g desta fruta, o número de mols da vitamina C que estaremos ingerindo a mais do que o recomendado será de, aproximadamente:
(Dados: H = 1; C = 12; O = 16)
a) 4,14 x 10 -2
b) 4,17 x 10 -2
c) 4,20 x 10 -2
d) 4,23 x 10 -2
e) 4,26 x 10 -2
13) A Amônia, que é utilizada na síntese de inúmeros e importantes compostos, é obtida pela seguinte reação em fase gasosa:
N2 + 3 H2 ====> 2 NH3
Fazendo-se reagir 4 litros de N2 com 9 litros de H2 em condições de pressão e temperatura constantes, pode-se afirmar que:
I – Após o final da reação, serão formados 6 litros de NH3.
II – Após o final da reação, os reagentes serão totalmente convertidos em amônia.
III – O volume final é maior que o inicial.
IV – Os reagentes não estão em quantidades estequiométricas.
Estão corretas apenas as afirmativas:
a) I e II
b) I e III
c) I e IV
d) II e III
e) II e IV
14) Uma pessoa mediu a massa das folhas de um formulário, antes e depois de preenchê-lo a lápis, tendo encontrado as massas 3,9928g e 4,0000g, respectivamente,. Considerando-se que não haja perdas, o grafitede seu lápis perdeu a seguinte quantidade de átomos>
(Dados: 6C12; nº de Avogadro = 6.02 x 1023)
a) 3,6 x 1020
b) 1027
c) 3,6 x 1027
d) 5,0 x 1026
e) 7,2 x 1020
15) Ao se misturar 147g de Ácido Sulfúrico com 156g de Hidróxido de Alumínio, ocorre uma reação que produz, respectivamente, as seguintes massas de Sulfato de Alumínio e de água:
(Dados: 1H1; 8O16; 13Al27 e 16S32)
a) 78g e 108g
b) 103g e 93g
c) 171g e 54g
d) 210g e 93g
e) 342g e 108g
16) O Alumínio é obtido pela eletrólise da Bauxita. Nessa eletrólise, ocorre a formação de Oxigênio que reage com os eletrodos de Carbono utilizados no processo. A equação não balanceada que representa o processo global é:
Al2O3 + C ====> CO2 + Al
Para dois mols de Al2O3, quantos mols de CO2 e Al, respectivamente, são produzidos nesse processo?
a) 3 e 2
b) 1 e 4
c) 2 e 3
d) 2 e 1
e) 3 e 4
17) A produção de Carboidratos (fórmula mínima CH2O), pelas plantas verdes, obedece à equação geral da fotossíntese: CO2 + H2O ====> CH2O + O2
Quantos litros de gás Carbônico, medidos nas CNTP, serão necessários para produzir 10g de Carboidrato:
a) 0,33
b) 7,5
c) 22
d) 44
e) 75
18) Na queima de fogos de artifício, o Fósforo reage com o Oxigênio do ar de forma espetacular, formando o P4O10. Para formar 3 mols deste óxido, quantos mols de O2 são necessários?
a) 3
b) 6
c) 12
d) 15
e) 30
19) Uma das maneira de impedir que o SO2, um dos responsáveis pela “chuva ácida”, seja liberado para a atmosfera, é tratá-lo previamente com Óxido de Magnésio, em presença de ar, como equacionado a seguir:
MgO + SO2 + ½ O2=====> MgSO4
Quantas toneladas de Óxido de Magnésio são consumidos no tratamento de 9,6 . 103 toneladas de SO2?
(Massas Molares: SO2 = 64 g / mol; MgO = 40 g / mol)
a) 1,5 . 102
b) 3,0 . 102
c) 1,0 . 103
d) 6,0 . 103
e) 2,5 . 104
20) Uma das reações que pode ocorrer entre Fe2O3 e CO é representada pela equação:
Fe2O3 + 3 CO ======> 2 Fe + 3 CO2
A massa de CO consumida na obtenção de 37 g de Fe será, aproximadamente , igual a:
(Dados: C = 12; O = 16; Fe = 56)
a) 28g
b) 42g
c) 56g
d) 70g
e) 84g
21) Cromo metálico pode ser produzido pela redução de Cr2O3 com Al segundo a equação:
2 Al + Cr2O3 ======> Al2O3 + 2 Cr
Supondo que a reação esteja completa, a massa de Cromo produzida pela reação de 54 kg de Al com 20 kg de Cr2O3 é:
(Dados: Cr = 52; Al = 27; O = 16)
a) 4,8 kg
b) 5,2 kg
c) 10,4 kg
d) 13,7 kg
e) 15,2 kg
22) Considere a reação em fase gasosa: N2 + 3 H2 =====> 2 NH3
Fazendo-se reagir 4 litros de N2 com 9 litros de H2 em condições de pressão e temperatura constantes, podes-se afirmar que:
a) Os reagentes estão em quantidades estequiométricas.
b) O N2 está em excesso.
c) Após o término da reação, os componentes serão totalmente convertidos em Amônia.
d) A reação se processa com aumento do volume total.
e) Após o término da reação, serão formados 8 litros de NH3.
23) São postos a reagir 63,0 g de Cu com 63,0 g de HNO3, segundo a equação balanceada:
3 Cu + 8 HNO3 =====> 3 Cu(NO3)2 + 2 NO + 4 H2O
Pode-se estequiometricamente concluir que há:
(Dados: Cu = 63 g / mol; HNO3 = 63 g / mol)
a) Excesso de 0,5g de Cu.
b) Consumo integral dos reagentes.
c) Formação de 18g de H2O.
d) Formação de 7,5g de NO.
e) n.d.a.
24) Uma amostra de 10g de calcário contém 8g de Carbonato de Cálcio. A porcentagem de pureza do Carbonato de Cálcio é:
a) 0,8%
b) 10%
c) 8%
d) 80%
e) 20%
25) No processo CaCO3 (s) ===> CaO (s) + CO (g), obteve-se 89,6 litros de CO2 nas CNTP, a partir de Carbonato de Cálcio com 80% de pureza. Nestas condições, a massa do Carbonato de Cálcio utilizado foi:
(Dados: Ca = 40; C = 12; O = 16)
a) 100g
b) 400g
c) 320g
d) 500g
e) 700g














Nenhum comentário:
Postar um comentário